GRUPOS DE INVESTIGACIÓN
Microbiología Estructural y Biodiseño
RESUMEN

LÍNEA DE INVESTIGACIÓN
Mecanismos moleculares de la regulación del metabolismo de nitrógeno en Actinobacteria
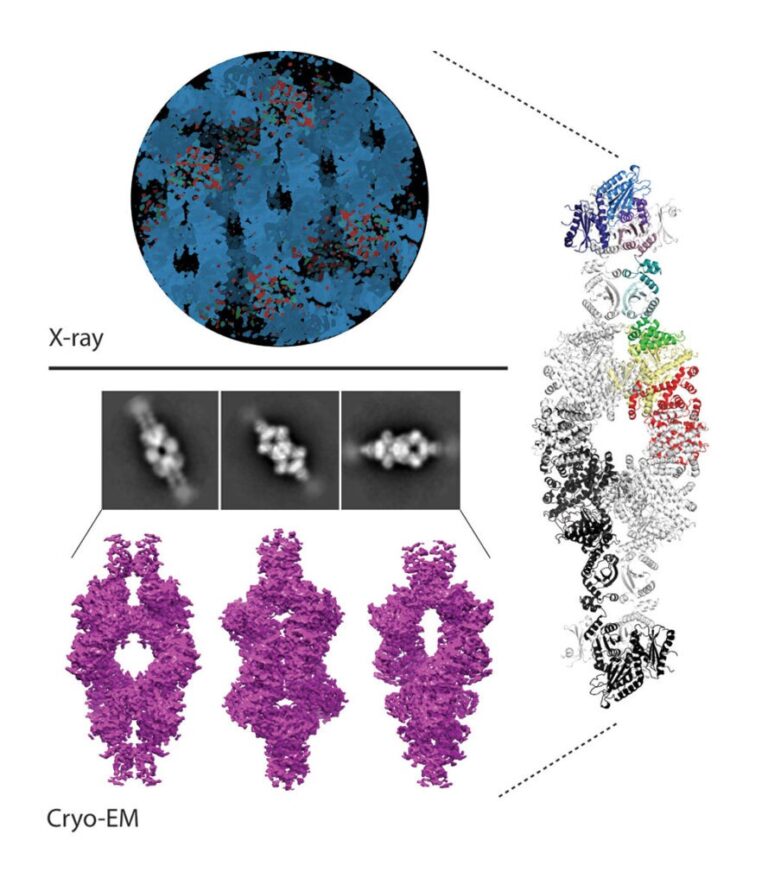
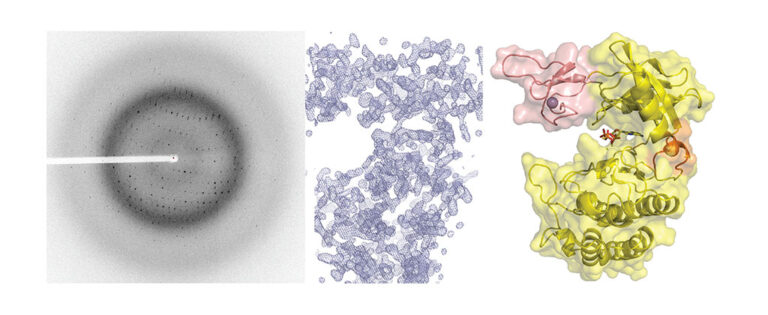
Hemos contribuido a demostrar que en diversas actinobacterias el metabolismo de nitrógeno es regulado por la vía de señalización que involucra a la quinasa de proteínas PknG. Tanto en el patógeno que causa tuberculosis en humanos como en especies de vida libre empleadas en procesos biotecnológicos, PknG controla los niveles intracelulares de glutamato en función de los aminoácidos presentes en el medio. Notablemente, la integridad de esta vía de transducción de señales es crítica para la virulencia del bacilo de Koch. En Mycobacterium el regulador GarA modula por interacción directa tres enzimas metabólicas, entre ellas una glutamato deshidrogenasa de alto peso molecular (L-GDH, L por large, en inglés). Esto determina que el alfa-cetoglutarato se desvíe del ciclo de Krebs en favor de la síntesis de glutamato; en cambio, la fosforilación de GarA por PknG inhibe la acción del regulador y el alfa-cetoglutarato es entonces direccionado al ciclo de Krebs. Recientemente elucidamos la estructura 3D de la L-GDH micobacteriana modulada por GarA. Estos hallazgos revelaron aspectos únicos de la arquitectura de este tipo de enzimas y sugieren mecanismos de regulación novedosos. Una comprensión profunda de los mecanismos moleculares involucrados en esta vía de señalización permitirá descifrar cómo M. tuberculosis y otras actinobacterias modulan su metabolismo y demás procesos fisiológicos claves. Esto aportará al diseño de drogas contra la tuberculosis y de innovaciones biotecnológicas.
SERVICIOS
Se brindan servicios tecnológicos a través de la Plataforma Argentina de Biología Estructural y Metabolómica PLABEM.
IMÁGENES DE NUESTRAS INVESTIGACIONES