Ivana Parcerisa, Germán Rosano y Eduardo Ceccarelli del Laboratorio de Estructura, Plegamiento y Función de Proteínas de nuestro Instituto han logrado por primera vez obtener en forma activa al chaperón molecular ClpB3 de plantas, caracterizándolo exhaustivamente a nivel bioquímico y molecular. El Laboratorio tiene una larga experiencia en el estudio de chaperones moleculares y ha realizado múltiples contribuciones en este campo.
Los chaperones moleculares son proteínas que ayudan al plegado, replegado o degradación de otras proteínas. Son esenciales para la vida normal de la célula y también para situaciones de crisis como enfermedades, alta temperatura o sequía, encontrándose presentes en todos los organismos vivos.
La proteína estudiada, ClpB3, se encuentra en los cloroplastos, organelas de plantas que tienen como función principal llevar a cabo la fotosíntesis. Estas organelas también participan en diversos procesos relevantes relacionados con la síntesis y almacenamiento de azúcares y otros compuestos importantes.
Modelo de acción de proteínas ClpB (celeste): las proteínas del tipo ClpB se unen a agregados proteícos (azul) y en presencia de ATP, los desenredan para que la proteína agregada vuelva a ser funcional. Imagen adaptada de Tyedmers et al., 2010.
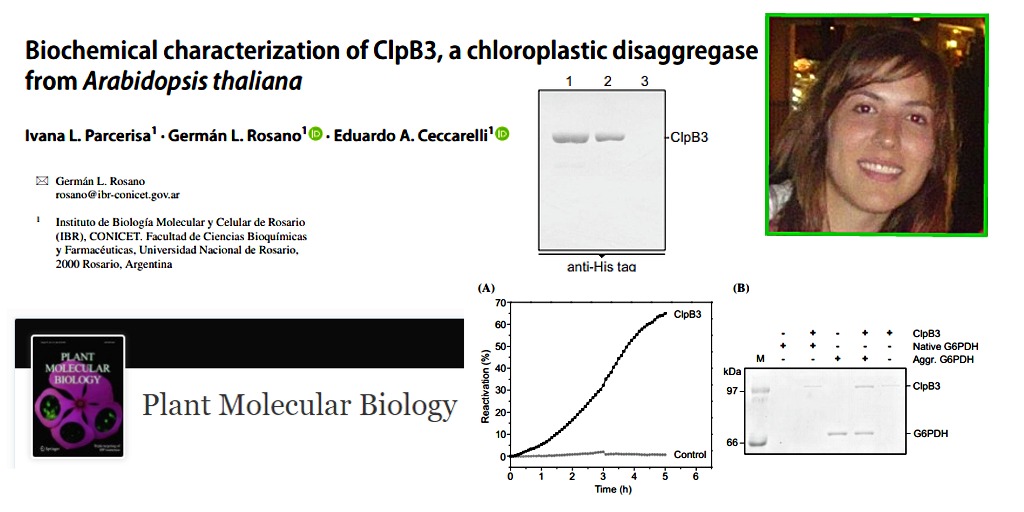
En este trabajo, se demostró que la proteína ClpB3 por sí sola tiene la capacidad de reactivar proteínas que habían sido desnaturalizadas por calor, restituyendo así la conformación activa de las mismas. Esta actividad es fundamental para que las plantas se defiendan de los procesos de estrés como temperaturas extremas, congelamiento o fenómenos que alteren su vida normal como el ataque de patógenos. Comprender estos procesos fundamentales abre un conjunto de posibilidades para el mejoramiento de plantas frente a ambientes hostiles.
El trabajo puede ser leído en su totalidad aquí:
Parcerisa, I.L., Rosano, G.L. & Ceccarelli, E.A. Biochemical characterization of ClpB3, a chloroplastic disaggregase from Arabidopsis thaliana. Plant Mol Biol (2020). https://doi.org/10.1007/s11103-020-01050-7